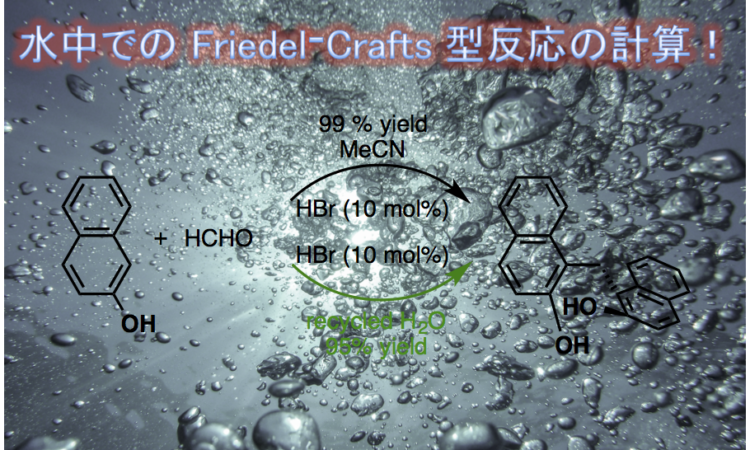
水中での Friedel–Crafts 型反応の計算に関する論文が最近出ましたので、簡単に紹介します。
“Mechanistic Investigation Inspired “On Water” Reaction for Hydrobromic Acid-Catalyzed Friedel–Crafts–Type Reaction of b-Naphthol and Formaldehyde”
Shanshan Cao, Haiyan Yuan, Yang Yang, Mang Wang, Xiaoying Zhang, and Jingping Zhang
J. Comput. Chem. in press. DOI: 10.1002/jcc.24877
概要
![]() –naphthol と formaldehyde と HBr 触媒を用いた Friedel–Crafts 型反応の改良を目的とし、DFT 計算を用いた反応機構の精査が行われました。優先する反応経路では、HBr-H
–naphthol と formaldehyde と HBr 触媒を用いた Friedel–Crafts 型反応の改良を目的とし、DFT 計算を用いた反応機構の精査が行われました。優先する反応経路では、HBr-H![]() O が共触媒として働き、協奏的に求核付加と水素移動反応が進行し、段階的にH
O が共触媒として働き、協奏的に求核付加と水素移動反応が進行し、段階的にH![]() Oの脱離と C–C結合形成が起こる。HBrの高い触媒活性の起源は、C–H—Br
Oの脱離と C–C結合形成が起こる。HBrの高い触媒活性の起源は、C–H—Br![]() とO–H—Br
とO–H—Br![]() の相互作用に帰され、活性種は Br
の相互作用に帰され、活性種は Br![]() であることが示唆される。さらに、水分子が Br
であることが示唆される。さらに、水分子が Br![]() をサポートしていることも明らかとなった。また、計算結果は溶媒の極性が活性化障壁に深刻な影響を与えることを示している。大変嬉しいことに、水中で優先する反応経路の律速段階の活性化の障壁は、アセトニトリルのそれと同等(0.6 kcal /mol の差)であった。この計算結果は実験的にも確認され、論文タイトルに示した反応が “水中” で首尾よく達成できることを実証した。本研究の成果は、ビフェノール誘導体の合成のための効率的かつ低環境負荷の新規合成戦略を切り拓いていくことに貢献する考えられる。
をサポートしていることも明らかとなった。また、計算結果は溶媒の極性が活性化障壁に深刻な影響を与えることを示している。大変嬉しいことに、水中で優先する反応経路の律速段階の活性化の障壁は、アセトニトリルのそれと同等(0.6 kcal /mol の差)であった。この計算結果は実験的にも確認され、論文タイトルに示した反応が “水中” で首尾よく達成できることを実証した。本研究の成果は、ビフェノール誘導体の合成のための効率的かつ低環境負荷の新規合成戦略を切り拓いていくことに貢献する考えられる。
内容
溶媒効果を見積もる方法はいくつかありますが、今回の論文では PCM モデルを用いて、再度構造最適化が行われました。
Fig 3 でHBr と水分子の組み合わせについて 5 通り検討されています。HBr 1 分子と水 2 分子を用いた場合のモデルがもっとも活性化エネルギーが低いようです。今回のように複数分子により構成されている系の計算を行う場合は、何分子ずつ用いたモデルがもっとも良いかを検討する必要があります。最低でも、水分子の数は検討する必要があるように思います。
Fig 5 では、他のハロゲン原子の場合についても考えられましたが、HBr > HCl > HI の順に触媒活性は低くなりました。つまり、HBr を用いた場合がもっとも活性化エネルギーが低いです。
計算の結果、律速段階は C–C 結合形成段階でした。しかし、論文の Fgure 6 を見てもらいたいのですが、水を溶媒として用いた場合とアセトニトリルではこの段階にはほぼ差がなく、活性化エネルギーはほぼ同じです。つまり、溶媒効果がもっとも強く作用するのは、最初の ![]() –naphthol と formaldehyde の反応の段階です。
–naphthol と formaldehyde の反応の段階です。
今回の論文では、(i)分子数の組み合わせを変えたモデル系の検討、(ii) 溶媒効果の検討、(iii)異なる酸の検討、(iv)バックグラウンド反応(非触媒反応)の検討など、きちんとポイントを抑えた論文だと思いましたので、紹介しました。